Fälschungssichere Lasermarkierung – metallische Implantate und OP-Instrumente dauerhaft eindeutig kennzeichnen
Executive Summary
Senodis bietet manipulationssichere, sterilisationsbeständige Lasermarkierung speziell für metallische Implantate und OP-Instrumente. Die Markierung erfüllt MDR- und UDI-Anforderungen, schafft die Basis für digitale Traceability – und reduziert Rückruf- sowie Prozesskosten so deutlich, dass sich die Investition meist innerhalb von sechs Monaten amortisiert.
Mit der Senodis Laser-ID verwandeln Sie Rückverfolgbarkeit von einer Pflichtaufgabe in einen echten Wettbewerbsvorteil – fälschungssicher, audit-ready und messbar profitabel.

Herausforderung
Strengere MDR-Pflichten: Seit 2021 (Klasse III) bzw. 2025 (Klasse I) verlangt die EU-MDR ein dauerhaft direktes UDI-Marking auf jedem kritischen Medizinprodukt. Klebe- oder Farbetiketten halten den geforderten Sterilisationszyklen jedoch nicht stand.
Rückruf-Risiko & Haftung: Im Schnitt kosten Rückrufe medizinischer Implantate bis zu 600 Mio. US-$; ein Großteil entsteht durch mangelnde Rückverfolgbarkeit.
Gefälschte Ersatz- und Drittteile: Counterfeit-Komponenten gefährden Patientensicherheit und Markenvertrauen; allein im EU-Binnenmarkt schätzt EUIPO die Folgekosten auf > €1,4 Mrd./Jahr.
Lösungsansatz
| Merkmal | Nutzen für QA/RA & Supply Chain |
|---|---|
| Sterilisationsbeständig ≥ 500 Zyklen | Kennzeichnung bleibt über gesamten Produktlebenszyklus lesbar, auch im Körper oder CSSD-Autoklav. |
| Manipulations- & fälschungssicher | Tiefe Gravur + eindeutiger, kryptografisch reservierter Nummernkreis verhindern Entfernung/Überprägen und blockieren Counterfeits. |
| UDI-ready | Markierung enthält alle Pflichtdatenelemente (DI + PI). Sie bildet die Grundlage, um diese Daten später – über Barcode-Scanner oder Vision-Systeme – an MES/ERP/EUDAMED anzubinden. |
| Inline-Verifikation vorbereitet | Offene Schnittstellen erlauben, bei Bedarf Kameras oder Handscanner einzubinden; Senodis liefert die „lesbare Signatur“, der Kunde entscheidet über die Datenintegration. |
Unsere Technologie erzeugt mikrotiefe, hochkontrastige DataMatrix- oder Klartextcodes direkt in Metalloberflächen (Titan, Edelstahl, CoCr).
Konkreter Einsatzbereich
| Prozessschritt | Technische Einbindung | Direkter Nutzen |
|---|---|---|
| Implantat-Fertigung (OEM) | Inline-Lasermarkierzelle direkt nach CNC-Finish; Nummernkreis wird per CSV / MES-Aufruf eingespeist | Fälschungsschutz ab Werk, keine Etiketten ⇒ 100 % MDR-konforme UDI noch vor Passivierung |
| Instrumenten-Reprocessing (CSSD) | Mobile Faserlaser-Workstation in der Sterilgutversorgung; Bedienung via Fußschalter & Handscanner | Kennzeichnung von Bestandsinstrumenten ohne Zusatzlogistik – Codes bleiben nach 500 Zyklen lesbar |
| Wareneingang Klinik/Lohnbearbeiter | Handscanner / Kamera-Gate liest DataMatrix; Sperrt unbekannte Seriennummer | Blockiert Counterfeit-Lieferungen, beschleunigt Freigabe & Bestandsbuchung |
Scope & Level
- Pilot: 1 Implantat-Finishzelle (Titan-Hüftstämme), 1 Laser- & Prüfstation, 1 Validierungs-Autoklav, 1 Klinik-CSSD-Partner
- Roll-out: 3 Werke, 6 Produktionslinien, 4 CSSD-Servicezentren, 75 000 Implantate + 10 000 OP-Instrumente/Jahr
- Systemgrenzen: Laser/Scanner ↔ MES ↔ QMS, MES ↔ QMS ↔ ERP (SAP) – bidirektionaler Seriennummer-Abgleich
Stakeholders
- QA/RA-ManagerIn: (MDR-/FDA-Compliance, Validierung (IQ/OQ/PQ), Audit-Readiness)
- ProduktionsleiterIn: OEE ≥ 97 % nach Integration, störungsfreie Shopfloor-Anbindung der Laserzellen
- IT / MES-Admin: Schnittstelle Laser / Scanner ↔ MES / ERP, Datenintegrität, Downtime ≤ 2 h/Jahr
- Supply-Chain-ManagerIn: Implantat- & Instrument-Tracking bis OP, Verlustquote < 0,5 %
- Finance / Controlling: ROI-Monitoring, Soll-/Ist-Abgleich der Einsparungen, Reporting ans Board
- Key Supplier (Laser & Scanner-OEM) Turn-key-Lieferung, Wartung > 95 % Anlagenverfügbarkeit, Bedienertraining
Trigger
- EU-MDR-Surveillance-Audit in 9 Monaten
- Dauerhaft gelaserte UDI-Codes auf jedem Einzelteil müssen verifiziert werden
- Recall-Near-Miss Q1/2025 (pot. Kosten ≈ 3,8 M €)
- Hohe Management-Priorität, Bedarf an chargengenauem Sperr-Workflow
- FDA-Deadline für Direktmarkierung Klasse II (Sept 2026)
- Internationaler Roll-out erforderlich, Harmonisierung Seriennummernformate
- Investitionsprogramm „Neue Implantatplattform 2025/26”
- Lasermarkierung kann in neue Linien integriert statt später teuer retro-fitted zu werden
Vorstandsvorgabe „Digitale Traceability bis 2026” Feste Budget- & Ressourcenzusage, klare Projekt-Deadline
- Lasermarkierung kann in neue Linien integriert statt später teuer retro-fitted zu werden
Kennzahlen
Tray-Setup-Zeit pro Eingriff
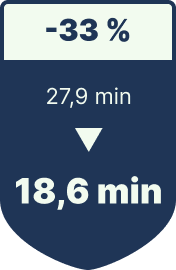
-33 % geringere Rüstzeit
Verpackungsdefekt-Rate

-77 % Fehlerkosten
Lesbarkeit nach 500 Sterizyklen

15x höhere Lebensdauer
Recall-Kosten pro Vorfall

-99 % Kapitalrisiko
(KPI, Veränderung, Wert vorher, Wert nachher)
Business-Nutzen & ROI
| Hebel | Vorher | Nachher | Einsparung / Jahr |
|---|---|---|---|
| OP-Tray-Setup-Zeit | 27,9 min / Eingriff | 18,6 min | ≈ 281 000 US-$ weniger OP-Leerlauf |
| Tape-/Etikettenersatz | Retaping alle ~30 Zyklen | entfällt komplett | ≈ 80 000 € Material + Arbeitszeit |
| Rückruf-Exposure | Worst case bis 600 M US-$ | Chargengenauer Rückruf < 1 M US-$ (projektiert) | > 99 % Risikosenkung |
| Verpackungsdefekt-Rework | 0,053 % Packfehler | 0,012 % | ≈ 35 000 € weniger Nacharbeit |
Implementierung (Roadmap)
| Phase | Dauer | Haupt-Stakeholder | Interner Aufwand |
|---|---|---|---|
| Machbarkeitsprüfung & Werkstofftests | 4 Wochen | QA/RA, Fertigungstechnik | ≈ 8 PT |
| Engineering, IQ/OQ & SOP-Erstellung | 12 Wochen | Produktion, Equipment-Engineering | ≈ 40 PT |
| PQ & MDR-Dokumentation | 8 Wochen | QA/RA, Regulatory Affairs | ≈ 30 PT |
| Roll-out & Training | fortlaufend | CSSD, Logistik, IT | 0,1 FTE Support |